Elektrophorese
(Verf.: H. Hübner)
Die Elektrophorese ist in der modernen biochemischen Analytik eine
Standardmethode und dient der Trennung, Identifizierung und Gewinnung
von geladenen (ionisierbaren) Molekülen. Solche Moleküle
können Aminosäuren, Peptide und Proteine aber auch
Nukleinsäuren, DNA-Fragmente und Glycoproteine sein. Die sich in
einer Lösung befindlichen Moleküle wandern als Kationen (+)
- geladen auf die Kathode und als Anionen (-) - geladen auf die Anode
zu.
Die Wanderungsgeschwindigkeit im elektrischen Feld hängt ab
von :
- Feldstärke
- Ladungsgröße des Moleküls
- Größe und Form des Moleküls (Molmasse)
- Trägermedium wie z.B. Papier, Celluloseacetat,
Agararose-Gel, Polyacrymid-Gel
- pH-Wert der Lösung / des Trägermediums
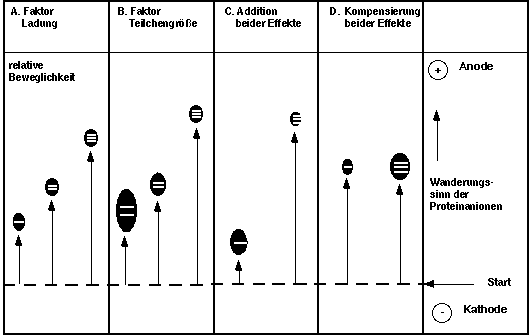
Den Zusammenhang von Wanderungsgeschwindigkeit, Ladung und
Molekülgröße veranschaulicht folgendes Schema:
|
|
|
A.
|
bei unterschiedlichen Ladungen, aber gleicher
Größe wandern die hochgeladenen Teilchen
besonders schnell
|
|
B.
|
bei gleicher Ladung und unterschiedlicher
Größe wandern die kleinen Moleküle
am schnellsten
|
|
C.
|
wenig geladene, große Moleküle
wandern am langsamsten
|
|
D.
|
ist das Verhältnis von Ladung und
Größe gleich,ist die
Wanderungsgeschwindigkeit gleich
|
|
Heute ist besonders die Gelelektrophorese zur Trennung von
Protein-Molekülen und DNA-Fragmenten in der Analytik und der
biochemischen Forschung nicht mehr wegzudenken.
Ziel dieser Trennungsverfahren ist es eine möglichst
große Auftrennung unter standardisierten Bedingungen zu
erreichen. Hierfür sind einige Maßnahmen notwendig, die
eine gleichmäßige Wanderung der Teilchen
gewährleisten.
- Die Feldstärke wird durch Anlegen einer stabilisierten
Gleichspannung erreicht, sie sollte 5-30 V/cm Trennweg nicht
überschreiten, da die Trennkammer sonst gekühlt werden
muß.
- Vom IEP hängt die Ladung des Protein-Moleküls ab.
Bei Protein- bzw, Aminosäuregemischen arbeitet man
zweckmäßigerweise bei einem konstanten pH-Wert. Dieses
wird durch s.g. Pufferlösungen erreicht, die den pH-Wert
einer Lösung während der Trennung stabil halten. Ist der
pH > IEP so liegen Proteinanionen, bei pH < IEP
Proteinkationen vor.
- Sollen nun Proteine aufgrund ihrer verschiedenen IEP-Werte
getrennt werden so spricht man von einer Proteintrennung durch
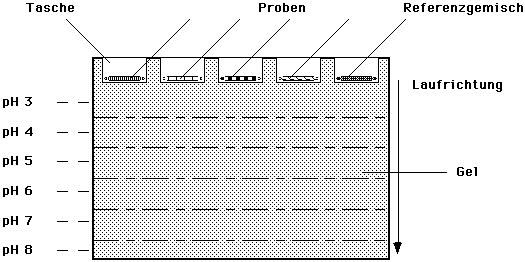
isoelektrische Fokussierung. Besonders Gele eignen sich als
Trägermedium, da man hier sehr gut Zonen mit verschieden
pH-Werten in die Laufstrecke einbringen kann, indem man die
einzelnen pH-Zonen nacheinander gießt (s.u.). Man beginnt in
der Nähe der Startlinie mit pH = 3 und ändert den
pH-Wert in Schritten von einer Einheit auf pH = 8.
|
|
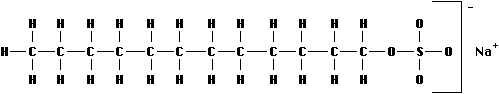
Natriumdodecylsulfat (NDS oder eng. SDS)
|
- Will man allerdings die Proteine nach der
Molekülgröße trennen, so kann mit einem weiteren
Trick das Verhältnis von Ladung ,
Molekülgröße und Form bei großen Proteinen
einstellen. Durch die Zugabe von Natriumdodecylsulfat (NDS oder
eng. SDS) und Anlagerung an die Proteine werden diese in eine
gestreckte Form und gleichzeitig in die Anionform umgewandelt. Es
entstehen Proteinanionen, bei denen die Größe der
Ladung proportional zu ihrer Molekülgröße ist. Bei
dieser Methode bleibt der pH-Wert im gesamten Gel konstant. Die
Eiweiße werden allerdings bei dieser Prozedur denaturiert,
sie verlieren bis auf die Primärstruktur ihre räumlichen
Strukturen. Läßt man nun ein Gemisch aus Proteinen mit
bekannten Molmassen (Referenz / Längenstandard) mitlaufen, so
kann durch Vergleich die Molmasse der einzelnen zu trennenden
Proteine bestimmt werden.
- Als Trägermedium für die Trennung nimmt man heute
meist Gele. Gele sind halbstarre Gebilde mit einer
Maschenstruktur. Die Wanderungsgeschwindigkeit hängt von der
Maschengröße bzw. von der Molekülgröße
der Proteine ab. Bei Polyacrylamid-Gel kann diese
Maschengröße ziemlich genau eingestellt werden, man
spricht vom Vernetzungsgrad dieses Kunststoffes. Es wird aus zwei
Komponenten, Pufferlösung und Wasser angemischt und vor dem
Erstarren zwischen zwei Glasplatten gegossen. Damit die Startlinie
einheitlich ist, formt man mit einem Kamm oben in das Gel Taschen,
in die später die Proben eingebracht werden. Die Probenmenge
kann sehr gering sein, schon 10 ng = 10-9 g reichen
aus.
|
|
Trenngel für isoelektrische Fokussierung
|
|
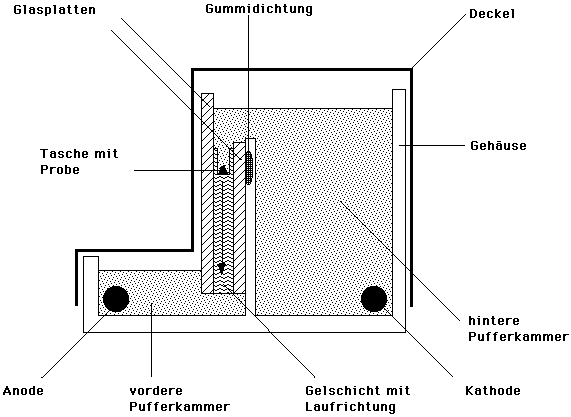
vertikale Elektrophoresekammer im Schnitt
|
- Nun stellt man die Gelplatte in eine mit Pufferlösung
gefüllte Elektrophoresekammer, schließt den Deckel und
trennt bei 120 V (Schulversuch)- 300 V ca, 1 - 2 h lang.
- Im Anschluß an die Trennung wird die Gelschicht
abgelöst und zunächst fixiert, anschließend
färbt man mit besonderen Farbstoffen die Proteinfraktionen an
,um sie sichtbar zu machen. Alternativ kann man die Proteine
radioaktiv markieren und in diesem Fall wird dann über das
Gel ein Röntgenfilm gelegt, der dann die Banden der einzelnen
Proteinfraktionen nach dem Entwickeln zeigt. Dieses Methode wird
heute im großen Stil in Analyse-Laboratorien zum Teil
automatisch angewendet.
- Da bei einer Elektrophorese immer ein Gemisch aus entweder
bekannten Proteinen oder Proteinen bekannter Molmasse mitlaufen
sollte, kann dieses Verfahren zur Identifizierung dienen. Wenn bei
der Gelelektrophorese die Molekülmasse das entscheidene
Trennkriterium ist, laufen kleine Proteine schnell, große
hingegen langsam.
Bei der isoelektrische Fokussierung hingegen wandern die Proteine
am weitesten, deren IEP am deutlichsten im basischen Bereich
liegt.
Man kann Gemische sowohl anhand von Zahl und Lage der Banden
unterscheiden, als auch einzelne Banden mit Hilfe der
Referenzsubstanzen identifizieren.
|
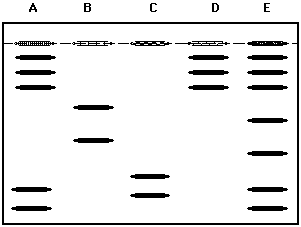
|
A,B,C,D sind verschiedene Proteingemische. E ist das
Referenzgemisch .
Das Pherogramm zeigt:
- Die Proteingemische sind nicht identisch, da Zahl und
Lage der Banden nicht übereinstimmen.
- Nur die Gemische A und D enthalten Proteine mit
bekannten Molmassen und sind zu identifizieren.
|
Quellen :
- B. Behrens Handbuch Gelelektrophorese, Phywe, Göttingen
1993
- Chemie heute Sek II , Schroedel Verlag, Hannover 1992
- H.Aebi, Einführung in die praktische Biochemie, Karger
Verlag, Basel 1971
- M.Engerer, M.Lederer, CHAMBA, Klett Schulbuchverlag Stuttgart
1990
 _Anleitung
zur Elektrophorese für Schüler
_Anleitung
zur Elektrophorese für Schüler
Last modifications made on December 4, 1998 by
Horst
Schecker

![]() _Anleitung
zur Elektrophorese für Schüler
_Anleitung
zur Elektrophorese für Schüler