Struktur der Proteine
(Verf.: C. Clausen)
(Abbildungen aus: O. Jacob & W. Hoffmann: Grundlagen der
Organischen Chemie. Bamberg: Buchner 1982)
Schon aus drei verschiedenen Aminosäuren können bereits
sechs unterschiedliche Tripeptide gebildet werden. Geht man von
größeren Peptideinheiten aus (Proteine), so nehmen die
Kombinationsmöglichkeiten fast unendliche Dimensionen an. In der
Tat sind Proteine die Naturstoffe mit der größten
chemischen Vielfältigkeit.
Die biologische Funktion eines Proteins ist bestimmt durch seine
besondere räumliche Struktur. In erster Linie wird die Struktur
durch die Reihenfolge der Aminosäure-Einheiten bestimmt.
Aufgrund der räumlichen Anordnung der Peptidbindungen neigen
Peptidketten dazu, geordnete Grundstrukturen einzunehmen, diese
werden als Sekundärstruktur charakterisiert.
Aus den Beziehungen zwischen den Seitenketten ergibt sich die
typische Teilchengestalt eines Proteins, die Tertiärstruktur,
hervorgegangen aus den Faltungen der Sekundärstruktur. Des
öfteren lagern sich zwei oder mehrere Peptidketten zu einer
kombinierten Struktur zusammen, diese nennt sich dann
Quartärstruktur.
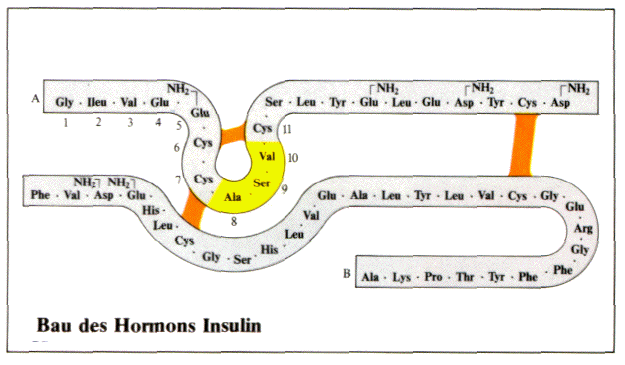
Primärstruktur
|
Zur Strukturaufklärung eines Proteins wird zuerst
die Zusammensetzung ermittelt: Anzahl und Art der
Aminosäure-Einheiten, damit die Aminosäuresequenz,
also die Primärstruktur. Sensationell war vor ca. 50
Jahren die Strukturaufklärung des Peptids INSULIN,
inzwischen läuft die Sequenzanalyse in den Laboren
routinemäßig ab. Bekannt sind heute die
Primärstrukturen von einigen tausend Proteinen.
|
|
Sekundärstruktur
|
Durch Röntgenuntersuchungen an kristallinen Peptiden
konnte festgestellt werden, daß bestimmte
räumliche Anordnungen wiederholt vorkommen. Unter
Einbeziehung von Molekülmodellen wurde als
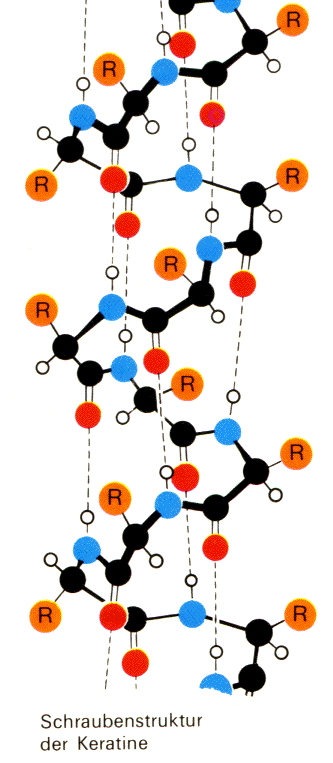
Grundstruktur die a-Helix abgeleitet. Dies besagt, daß
die Peptidkette schraubenartig gewunden ist. Die
Peptidbindungen bilden die Außenwand eines
Hohlzylinders, von dem aus nach außen die
Aminosäure-Seitenketten herausragen. Die a-Helix
stabilisiert sich durch intramolekulare
Wasserstoffbrückenbindungen zwischen den
Peptid-Gruppen. Das Sauerstoffatom der CO-Gruppe eines
Aminosäure-Bausteins tritt jeweils mit dem
Wasserstoff-Atom der NH2-Gruppe des übernächsten
Bausteins in Beziehung. Der Windungsabstand dieser a-Helix
beträgt 540 pm, also auf eine Windung kommen demnach
3,6 Aminosäure -Bausteine.
Außerdem bildet sich eine weitere
Sekundärstruktur in Form eines b-Faltblatts heraus. Es
ist eine zickzackförmig gefaltete Fläche. Die
Peptidbindungen mehrerer parallel angeordneter Ketten treten
nun in Wechselwirkung, wobei sich intermolekulare
Wasserstoffbrücken-Bindungen ausprägen.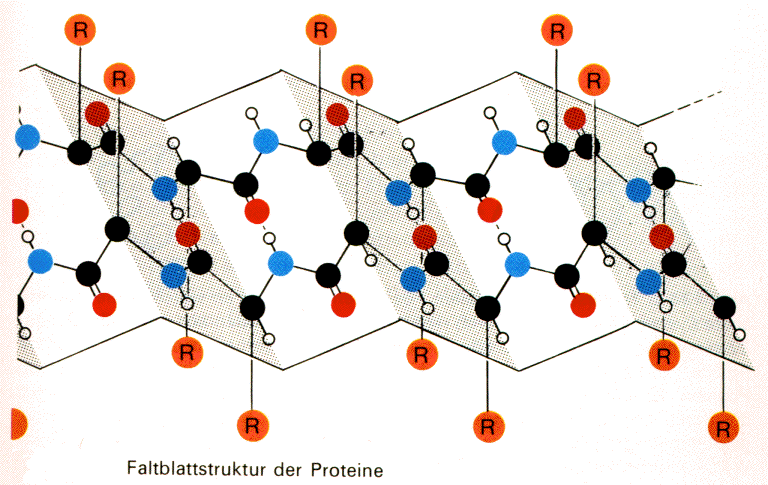
|
|
Tertiärstruktur
|
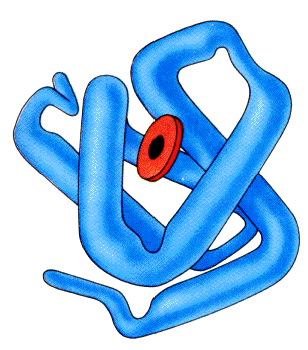
Proteine haben die Eigenschaft, bei gleicher
Primärstruktur immer die gleiche typisch gewundene und
gefaltete dreidimensionale Struktur auszubilden. Diese
Tertiärstruktur wird durch unterschiedliche
Bindungsarten festgelegt: Zwischen polaren Seitenketten der
Aminosäuren-Einheiten bilden sich
Wasserstoffbrückenbindungen aus. Unpolare und schwach
polare Gruppen bilden untereinander typische
van-der-Waals-Bindungen aus. Positiv geladene
Ammoniumgruppen und negativ geladene Carboxylat-Gruppen
gehen Ionenbindungen ein. Von großer Wichtigkeit
für die Tertiärstruktur sind die besonderen
Disulfidbrücken ( -S-S-). Hier liegen
Elektronenpaarbindungen vor, die sich aus den SH- Gruppen
zweier Cystein-Reste gebildet haben.
Auf die Löslichkeit eines Proteins in Wasser wirkt
sich die Tertiärstruktur direkt aus. Dabei lassen sich
die Proteine in Hauptgruppen einteilen: Globuläre
Proteine mit kugelförmiger Gestalt der Moleküle
und guter Löslichkeit in Wasser, sowie in
Faserproteine, deren gestreckte Moleküle in Wasser
unlöslich sind
Bei den globulären Proteinen zeigen polare und
ionische Seitenketten nach außen. Sie gehen mit
Wasser-Molekülen Wasserstoffbrückenbindungen ein
und sind demnach für die Löslichkeit in Wasser
verantwortlich. Im Inneren des globulären Proteins
liegen Bereiche mit van-der-Waals-Bindungen vor, solche
Bereiche sind praktisch absolut frei von
Wasser-Molekülen.
|
|
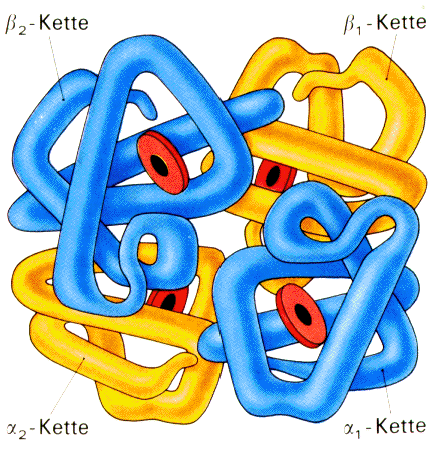
Quartärstruktur
|
Wenn ein Protein nicht nur aus einer einzigen
Polypeptidkette besteht, sondern aus mehreren Ketten,
spricht man von einer Quartärstruktur. Berühmtes
Beispiel hierzu ist das Hämoglobin, das im Blut
Sauerstoff-Moleküle transportiert. Es ist aufgebaut aus
vier Polypeptidketten in der Größenordnung von
jeweils ca. 145 Aminosäure-Resten. Auch viele andere
Proteine sind aus mehreren Polypeptidketten
zusammengesetzt.
|
|
Denaturierung
Unter normalen physiologischen Bedingungen sind die Tertiär-
und Quartärstrukturen von Proteinen sehr stabil. Das Erhitzen
auf über 60 ° C führt jedoch bei den meisten Proteinen
zu einer irreversiblen Zerstörung dieser Strukturen. Dieses
bezeichnet man als Denaturierung. Bei diesen Vorgängen geht die
biologische Funktionsfähigkeit verloren. Beim Eierkochen bildet
sich festes Eiweiß, das ist ein typisches Beispiel für
eine Denaturierung. Außerdem können Säuren, Laugen,
Schwermetall-Ionen, Harnstoff und andere Reduktionsmittel die
Denaturierung bewirken, die insbesondere die Disulfidbrücken
aufspalten.
Last modifications made on June 8. 1999 by
Horst
Schecker




