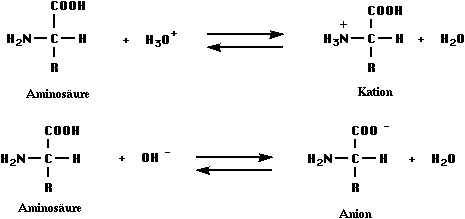
Aminosäuren besitzen die Carboxylgruppe als Säure-Gruppe und die basisch reagierende Amino-Gruppe. Folglich sind sie amphotere Verbindungen, die sowohl mit Säuren als auch mit Basen Salze bilden.
Dasselbe gilt für die Proteine, da sie aus Aminosäuren aufgebaut sind:

Die Abbildung verdeutlicht, dass Aminosäuren und Proteine in Gegenwart von Lauge bzw. im alkalischen ( basischen) Bereich als negativ geladene Anionen und in saurer Lösung als positiv geladene Kationen vorliegen.
In wässriger Lösung ist die oben beschriebene Säure-Base-Reaktion ebenfalls möglich:
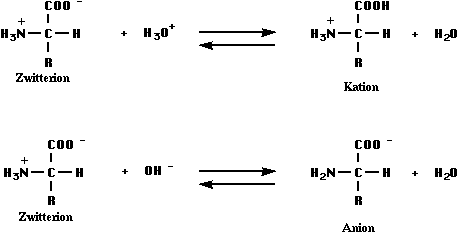
Die neutralen Aminosäuren geben mehr Protonen an Wasser ab, als im zweiten Schritt von der Aminogruppe wieder aufgenommen werden., d.h. dass diese Aminosäuren in Wasser schwach sauer reagieren ( pH ca. 6 ).
Die gute Löslichkeit der Aminosäuren in polaren Lösemitteln ist auf die Bildung von Anionen, Kationen oder Zwitterionen zurückzuführen, die zum Beispiel in Wasser Hydrathüllen bilden können.
Zur Wasserlöslichkeit vieler Proteine trägt außerdem bei, dass die funktionellen Gruppen der an ihrem Aufbau beteiligten sauren und basischen Aminosäuren als Anionen oder Kationen vorliegen.
Aminosäure- und Proteingemische wandern als Anionen bzw. Kationen im elektrischen Feld. Die Wanderungsgeschwindigkeit ist abhängig von der Größe und der Raumstruktur ( und der Anzahl der zusätzlichen Ladungen ) der Aminosäuren bzw. Eiweißstoffe.
Trägt sowohl die Carboxyl- als auch die Aminogruppe eine Ladung, dann liegt die Aminosäure bzw. das Protein als Dipolmolekül vor, das sich im elektrischen Feld zwar ausrichten, aber nicht wandern kann. Die Verbindung hat dann ihren isoelektrischen Punkt (IEP) erreicht, d.h. sie erscheint nach außen hin ungeladen.
Proteine flocken am IEP in wässriger Lösung aus, weil sich die innermolekularen Ionenladungen gegenseitig aufheben und nach "außen" keine Ladung mehr wirksam ist, um die sich eine Hydrathülle bilden könnte. Dadurch kann jedes Eiweißmolekül an seinem IEP aus einem Proteingemisch spezifisch ausgefällt werden.
Aus der Lage des IEP eines Proteins auf der pH-Skala kann man darauf schließen, ob an seinem Aufbau überwiegend saure, basische oder neutrale Aminosäuren beteiligt sind.
Durch Elektrophorese werden Proteine im elektrischen Feld auf Grund ihres Ladungszustandes und / oder ihrer Masse getrennt.
Die Aminosäuren haben die Eigenschaft sich untereinander zu Ketten zu verbinden. Dabei reagiert die Carboxylgruppe der ersten Aminosäure mit der Aminogruppe der zweiten Aminosäure unter Abspaltung von Wasser:
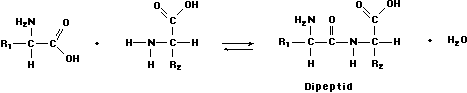
Die entstehende Säureamidbindung bezeichnet man als Peptidbindung. Sie erfolgt stets über die funktionellen Gruppen des ý-C-Atoms und nicht über die Seitenketten.
So entsteht eine Molekülkette, in der sich die Bindungsgruppen gleichmäßig wiederholen:
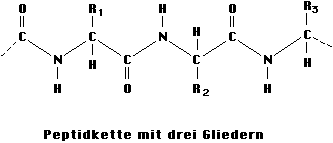
In alkalischer und in saurer Lösung wird diese Bindung unter Anlagerung von Wasser wieder gespalten (Hydrolyse). Die vollständige Hydrolyse der Peptidbindungen eines Proteins lässt sich in Gegenwart sehr starker Salzsäure innerhalb von ca. 24 Stunden erreichen, die alkalische Hydrolyse erfolgt schneller. Die große Stabilität der Peptidbindung ist auf die besonderen Bindungsverhältnisse in der -CO-NH- Gruppierung zurückzuführen.